Les effets dommageables de l’activation excessive du complément

L’activation excessive du système du complément peut accélérer la détérioration des cellules juste à l’extérieur de la lésion,
augmentant le risque de croissance des lésions de l’atrophie géographique (AG)1-4
Le système du complément joue normalement un rôle central dans la défense du système immunitaire contre les pathogènes et les cellules anormales5. Cependant, chez les patients atteints d’AG, des degrés élevés d’activité du complément ont été constatés non seulement dans la lésion, mais aussi en périphérie4,6.
Cette activation excessive du système du complément peut conduire à un excès de phagocytose, d’inflammation et de lyse cellulaire, qui aboutit à la mort des cellules rétiniennes1,5.
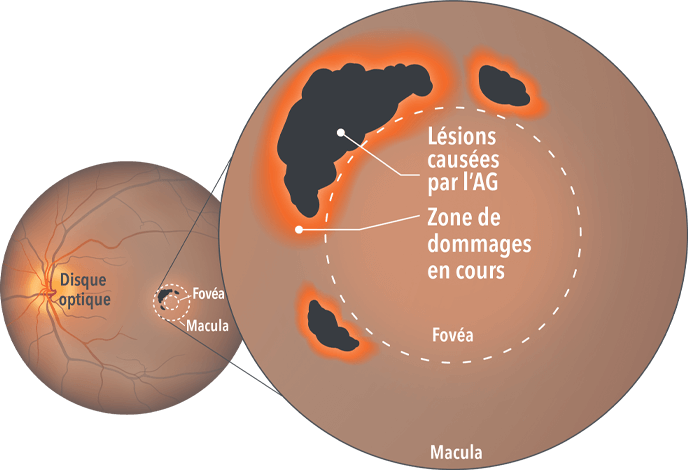
Voyez les conséquences de l’activation excessive du complément en cas d’AG
Lorsque les dommages à la rétine sont irréversibles, il s’agit d’atrophie géographique, ou « AG ». Pour découvrir ce qui se cache derrière la destruction, allons voir sous la surface.
Dans cette forme avancée de dégénérescence maculaire liée à l’âge sèche, des lésions atrophiques se forment sur la macula, causant une perte de vision fonctionnelle lorsqu’elles s’étendent. Ce groupe de protéines est appelé « système du complément ». Normalement, il combat les pathogènes et élimine les cellules anormales, mais en cas d’atrophie géographique, ou « AG », il peut devenir néfaste s’il est trop actif.
Cette protéine centrale, C3, joue un rôle clé dans l’activité excessive du complément. L’activation du complément entraîne le clivage de C3, qui se sépare en fragments actifs, C3a et C3b. Au-dessus de ce photorécepteur, des C3a ont commencé à s’accumuler. L’excès de C3a peut déclencher une inflammation chronique de la macula, laquelle peut contribuer à la mort cellulaire.
Ici, un groupe de C3b s’accumule sur la surface des cellules, ce qui les identifie comme candidates à la phagocytose par les cellules immunitaires. Mais les C3b sont loin d’en avoir fini : ils ont également des effets significatifs sur la cascade du complément, entraînant une collaboration chez les composants en aval, qui forment une nouvelle structure, le complexe d’attaque membranaire. Celui-ci, se fixe aux membranes cellulaires de l’épithélium pigmentaire rétinien, ou « EPR », et des photorécepteurs, dans lesquelles il crée des ouvertures.
C3 est une protéine centrale du système du complément, toutefois lorsque ce dernier est trop activé, elle joue un rôle déterminant dans l’inflammation, la phagocytose et la rupture des membranes cellulaires.
Ensemble, ces trois mécanismes mènent finalement à la mort des cellules de la rétine.
L’activation excessive du système du complément a été associée à la croissance des lésions de l’AG4
C3 joue un rôle central pour déclencher les multiples effets dommageables en aval de l’activité excessive du complément en présence d’AG, qui peuvent conduire à la mort des cellules rétiniennes4,7-9
C3 est le pivot de l’activation excessive du complément en présence d’AG4,7,8


C3b est impliqué dans une boucle d’amplification de l’activation du complément4,10
Les trois voies du complément convergent vers C3, entraînant le clivage de C3 en composants C3a et C3b et les effets en aval3

Activation et recrutement des cellules inflammatoires (par C3a et la protéine C5a en aval)5,6,9
Accumulation du complément marquant les cellules pour la phagocytose (par C3b)5,6,10
Désorganisation de la membrane cellulaire par la formation du complexe d’attaque de la membrane (par les protéines en aval C5b-9)7,8

Écoutez vos
pairs
Des experts partagent leurs points de vue et leur expérience de la prise en charge des patients atteints d’AG.

Inscrivez-vous pour rester au courant!
Communiquez avec nous pour recevoir des mises à jour et des renseignements de la part d’Apellis.

Références :
- Boyer, D.S., U. Schmidt-Erfurth, M. van Lookeren Campagne et coll. « The pathophysiology of geographic atrophy secondary to age-related macular degeneration and the complement pathway as a therapeutic target », Retina, 2017;37(5):819-835. doi:10.1097/iae.0000000000001392.
- Park, D.H., K.M. Connor et J.D. Lambris. « The challenges and promise of complement therapeutics for ocular diseases », Front Immunol, 2019;10:1007. doi:10.3389/fimmu.2019.01007.
- Yates, J.R.W., T. Sepp, B.K. Matharu et coll. (Genetic Factors in AMD Study Group). « Complement C3 variant and the risk of age-related macular degeneration », N Engl J Med, 2007;357(6):553-561. doi:10.1056/NEJMoa072618.
- Katschke, K.J. Jr, H. Xi, C. Cox et coll. « Classical and alternative complement activation on photoreceptor outer segments drives monocyte-dependent retinal atrophy », Sci Rep, 2018;8(1):7348. doi:10.1038/s41598-018-25557-8.
- Merle, N.S., S.E. Church, V. Fremeaux-Bacchi et L.T. Roumenina. « Complement system part I – Molecular mechanisms of activation and regulation », Front Immunol, 2015;6:262. doi:10.3389/fimmu.2015.00262.
- Smailhodzic, D., C.C. Klaver, B.J. Klevering et coll. « Risk alleles in CFH and ARMS2 are independently associated with systemic complement activation in age-related macular degeneration », Ophthalmology, 2012;119(2):339-346. doi:10.1016/j.ophtha.2011.07.056.
- Mastellos, D.C., E.S. Reis, D. Ricklin, R.J. Smith et J.D. Lambris. « Complement C3-targeted therapy: replacing long-held assertions with evidence-based discovery », Trends Immunol, 2017;38(6):383-394. doi:10.1016/j.it.2017.03.003.
- Ricklin, D., E.S. Reis, D.C. Mastellos, P. Gros et J.D. Lambris. « Complement component C3 – The “Swiss Army Knife” of innate immunity and host defense », Immunol Rev, 2016;274(1):33-58. doi:10.1111/imr.12500.
- Heesterbeek, T.J., Y.T.E. Lechanteur, L. Lorés-Motta et coll. « Complement activation levels are related to disease stage in AMD », Invest Ophthalmol Vis Sci, 2020;61(3):18. doi:10.1167/iovs.61.3.18.
- Seddon, J.M., Y. Yu, E.C. Miller et coll. « Rare variants in CFI, C3 and C9 are associated with high risk of advanced age-related macular degeneration », Nat Genet, 2013;45(11):1366-1370. doi:10.1038/ng.2741.
